01:11
Pusťte si video znovunebo se podívejte na další.
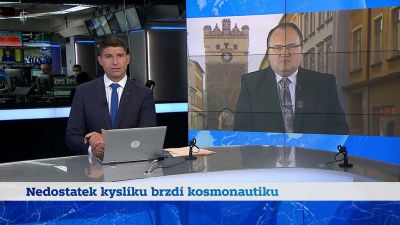
Pokus: Reakce kyseliny chlorovodíkové s kovy
Kyselina chlorovodíková reaguje s některými kovy za vzniku vodíku. Zinek a železo jsou neušlechtilé kovy, proto s nimi kyselina reaguje. Naopak s mědí nereaguje, protože měď je ušlechtilý kov.